1) Uma quantidade de calor
produz mudança de temperatura em um corpo, ocorrendo assim trocas de calor
entre corpos, até atingir o equilíbrio térmico. Essa afirmativa se refere a que
tipo de calor?
(A) Calor Específico
(B) Calor Sensível
(C) Calor Latente
(D) Calor Forte
2) Julgue cada uma das afirmativas como verdadeira (V) ou
falsa (F):
a) Após a mistura, de duas
amostras de água, inicialmente a temperaturas diferentes, há transferência da
amostra mais quente para a mais fria, até atingirem o equilíbrio. ( )
b) O calor
específico indica um comportamento quando uma substância é colocada para
realizar trocas de calor. ( )
c) A
depender do valor do calor específico de uma substância, podemos analisar sua
habilidade de ceder ou absorver energia térmica. ( )
d) O
equilíbrio térmico de dois corpos depende somente da massa destes dois corpos.
( )
e) A
quantidade de energia transferida, na forma de calor, é considerada negativa
quando a temperatura do objeto diminui, ou seja, a energia foi cedida pelo
objeto. ( )
3) Por que quando queremos tomar uma bebida gelada, precisamos aguardar
algum tempo depois de colocá-la na geladeira?
(A) Temos que esperar para que a bebida
esfrie na geladeira até que comece a ocorrer uma mudança de estado.
(B) Devemos aguardar até que a bebida
entre em equilíbrio térmico com a geladeira, ou seja, que fiquem com a mesma
temperatura.
(C) Para se fazer a transferência de
calor para o frio.
(D) Porque a bebida está na temperatura quente
e tem que colocar ao congelador para que ela se gele.
4) Quando
misturamos 1 kg de água (calor específico = 1 cal/g°C) a 70°C com 2 kg de água
a 10°C, obtemos 3 kg de água a que temperatura?
5) Misturam-se 300g de alumínio (calumínio = 0,22 cal/g∙°C) a 100°C com 125g de água a 20°C, em um ambiente de capacidade térmica desprezível. Determine a temperatura de equilíbrio térmico.
Se T1 ≠ T2, existe troca de calor entre ambos
(representado no esquema pela flecha).
Abaixo damos os valores das temperaturas T1 e T2 de três sistemas diferentes.
Coloque-os em ordem crescente de calor
trocado.
- T1 = 10ºC e T2 = 10ºC
- T1 = 0ºC e T2 = 23ºC
- T1 = 50ºC e T2 = 80ºC
2) O que é um calorímetro?
Se misturarmos 100g de água a
20°C e 100g de água a 80°C num calorímetro, podemos calcular qual será a
temperatura final da mistura, ou seja, a temperatura de equilíbrio térmico.
m₁ = 100 g
T₁ = 20 ºC
c₁ = 1 cal/g∙ºC
m₂ = 200 g
T₂ = 50 ºC
c₂ = 1 cal/g∙ºC
m₁ · c₁ · (Tf - T₁) +
m₂ · c₂ · (Tf - T₂) = 0
100 · 1 · (Tf - 20) +
200 · 1 · (Tf - 50) = 0
100 · (Tf - 20) + 200 · (Tf
- 50) = 0
100 Tf - 2 000 + 200 Tf - 10 000 = 0
100 Tf + 200 Tf = 0 + 2 000 + 10 000
300 Tf = 12 000
Tf = 12 000 / 300
Tf = 40 ºC
Principais pontos
·
Temperatura
·
Calor
·
Equilíbrio térmico
Introdução
Historicamente,
o conceito de calor foi um dos mais difíceis de serem construídos. Os primeiros
pensadores associavam o calor ao fogo e à suas manifestações, atribuindo sempre
enorme valor ao mesmo.
Heráclito
de Éfeso (535 - 470 a.C.) considerava o fogo como o elemento responsável pelas
transformações no universo. Empédocles (492 - 432 a.C.) elaborou um esquema
explicativo com base nos chamados quatro elementos primordiais (água, ar, terra
e fogo), relacionando o conceito de calor ao fogo.
Para
Aristóteles (384 - 322 a.C.) o frio e o quente eram propriedades fundamentais
dos corpos, assim como o leve e o pesado.
A
associação do calor ao movimento das partículas que compõem um corpo foi feita
inicialmente por Platão (427 - 347 a.C.). Ele acreditava que o calor do fogo
fazia com que as partículas entrassem em movimento e se separassem, provocando
a dilatação do corpo. Ao retirar o corpo do fogo, Platão acreditava que ocorria
o efeito inverso - as partículas paravam de se mover e eram comprimidas fazendo
com que o tamanho do corpo diminuísse.
Hoje
sabemos que o calor existe apenas quando existe diferença de temperatura entre
dois sistemas colocados em contato térmico. Cabe ressaltar que o contato
térmico não exige necessariamente contato físico, visto que o calor se propaga
pelos processos de convecção, condução e irradiação.
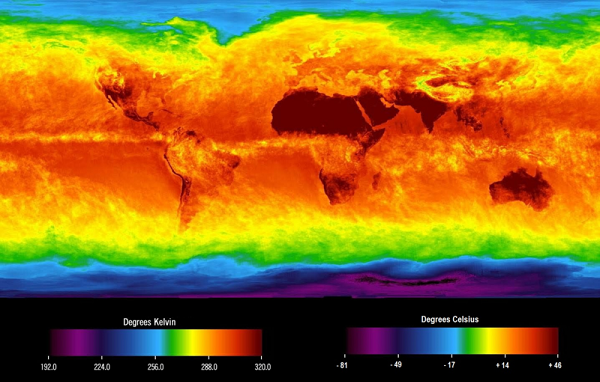 |
Figura
1: Mapa de temperaturas médias da Terra feito por observações de satélites no
mês de abril de 2013. Pode-se perceber que os pólos Norte e Sul são mais frios
do que a região tropical. Essa diferença de temperatura na Terra é responsável
pelos ventos e furacões, que nada mais é do que a troca de calor por convecção.
Crédito: NASA, domínio público. Disponível em https://commons.wikimedia.org/wiki/File:Global_surface_brightness_temperature._April_2013.png.
Acesso em 18/09/18. |
A
irradiação, diferentemente da condução e convecção, não exige contato físico. É
por este processo que a Terra é aquecida pelo Sol – o calor que a Terra recebe
do Sol se dá pela diferença de temperatura dos mesmos.
Temperatura
O
conceito de temperatura como o quão quente ou frio está um corpo não é
confiável, pois as sensações térmicas além de serem subjetivas, dependem do
tipo de material que tocamos.
Por
exemplo, podemos guardar um pedaço de madeira e outro de metal no congelador
por dias. Ambos estarão na mesma temperatura, a dada pelo congelador, lógico!
Porém, ao retirarmos ambos os objetos, teremos a sensação de que a madeira
estará mais quente do que o metal. Isso tem relação com a capacidade dos
materiais de trocar calor com corpos mais quentes ou mais frios do que eles.
A
sensação de calor ou frio é comparativa. Experimente colocar uma mão na água
quente e a outra na água com gelo. Após alguns instantes, coloque as duas mãos
em uma bacia contendo água à temperatura ambiente. A sua mão que estava na água
quente, sentirá que a água da bacia está fria. Já a sua mão que estava na água
com gelo, sentirá a água da bacia quente.
Como
podemos então definir o conceito de temperatura?
O
físico William Tomson (conhecido como Lord Kelvin, 1824 - 1907) durante seus
estudos do comportamento dos gases, estabeleceu que a temperatura de um corpo
representa a energia média de movimento dos átomos e/ou moléculas que o
constituem.
Kelvin
fez uma adequação da teoria de Platão, associando o não movimento ou repouso
das partículas de um corpo ao zero na escala Kelvin de medição de temperaturas
– o zero absoluto. Esse valor é inatingível, o que significa que os átomos e/ou
moléculas estão sempre em movimento, por mais lento que ele seja.
O
aumento da movimentação das partículas (átomos e/ou moléculas) de um corpo está
diretamente associado ao aumento da temperatura do mesmo. E vice-versa.
A
temperatura é definida então como a medida da energia de movimento dos átomos
e/ou moléculas que compõem um corpo, seja ele um sólido, líquido ou gás.
Calor
Conforme
falado, o calor é a energia térmica transferida entre dois sistemas ou corpos
(sejam eles gases, líquidos ou sólidos) devido a uma diferença de temperatura
existente entre eles.
O
calor é espontaneamente transferido do corpo que possui temperatura mais alta
para o que possui temperatura mais baixa. Ou seja, ocorre transferência de
calor entre partículas mais energéticas (que se movimentam mais rápido) para as
menos energéticas.
Assim,
quando pegamos uma xícara com café quente a energia é transferida da xícara
para nossa mão e, quando pegamos um copo de água com gelo, a energia é
transferida da nossa mão para o copo. Ou seja, quando dois corpos estão em
contato térmico, a transferência de energia ocorre sempre do mais quente para o
mais frio.
Só
faz sentido falar em calor enquanto os corpos possuírem temperaturas diferentes
entre si. Uma vez que os corpos estiverem na mesma temperatura deixa de ocorrer
o fluxo de energia, ou seja, deixa de existir calor. Nessa condição dizemos que
os corpos atingiram o equilíbrio térmico.
 |
Figura
2: Esquema da troca de calor entre dois corpos com temperaturas diferentes.
Crédito: Yuri ygc, domínio público. Disponível em https://commons.wikimedia.org/wiki/File:Fluxo_de_calor_correto.jpg.
Acesso em 18/09/18. |
Vamos voltar agora ao exemplo do pedaço de madeira e de metal guardados no congelador. Se ambos estão na mesma temperatura por que ao pegá-los temos a sensação de que a madeira está mais quente e o metal mais frio?
Porque
a capacidade do metal de receber calor da sua mão é maior do que a capacidade
da madeira. Como o metal “rouba” o calor da sua mão mais rapidamente, você tem
a sensação que ele está mais gelado. Na verdade quando você pega o metal a sua
mão esfria mais rápido por ter cedido mais calor ao metal do que à madeira no
mesmo intervalo de tempo.
O
mesmo acontece quando aquecemos a mesma quantidade de duas substâncias
diferentes, por exemplo, de água e de ferro. O ferro terá sua temperatura
aumentada em muito pouco tempo, enquanto que a água precisará de mais tempo
para alcançar a mesma temperatura alcançada pelo ferro.
É
fácil perceber que as substâncias têm capacidades diferentes de trocar calor.
Foram definidos dois conceitos físicos para categorizar essas diferenças, a
capacidade térmica e o calor específico.
A
quantidade de calor necessária para variar a temperatura de certa quantidade de
substância é chamada de Capacidade Térmica. Já a quantidade de calor necessária
para elevar em 1oC, 1g da substância é denominada Calor Específico.
Quanto
menor o calor específico de uma substância, mais facilmente ela sofre variações
em sua temperatura.
Na
tabela abaixo damos o calor específico de algumas substâncias, a título de
comparação. Observe que os valores dos calores específicos condizem com as
explicações para o encontrado no experimento da madeira e metal guardados no
congelador.
|
Substância |
Calor específico (J/kg⋅°C) |
|
Cobre |
387 |
|
Vidro |
840 |
|
Madeira |
1700 |
|
Água (a 15°C) |
4186 |
Equilíbrio
térmico
O
equilíbrio térmico de um sistema é atingido quando todos seus constituintes
atingem o mesmo valor de temperatura e não existe troca de calor entre eles.
Esse
princípio é a base do funcionamento de todos os termômetros. Você já reparou
que para medir a temperatura de uma pessoa coloca-se o termômetro e espera-se
um tempo? Esse tempo é necessário para que o equilíbrio térmico entre seu corpo
e o termômetro seja atingido, de modo que a temperatura que ele mostra seja
igual à da pessoa.
Isso
vale para a medição da temperatura de qualquer substância (sólido, líquido ou
gás) com qualquer tipo de termômetro; é preciso esperar que o sistema entre em
equilíbrio térmico antes de fazer a leitura da temperatura.
 |
Figura 3: Esquema mostrando o
equilíbrio térmico entre dois corpos. Crédito: Yuri ygc, domínio público.
Disponível em https://commons.wikimedia.org/wiki/File:Fluxo_de_calor.jpg.
Acesso em 18/09/18.























