1) O que é energia interna de
um gás?
A energia interna de um gás corresponde à soma das energias cinéticas individuais (de movimento) de suas moléculas e é diretamente proporcional à sua temperatura absoluta.
2) O que se entende como a
Energia Cinética de cada molécula do gás?
No gás as moléculas se apresentam mais distanciadas do que nos outros
estados físicos da matéria e que praticamente elas não interagem entre si, a
não ser durante as colisões. O movimento das moléculas de um gás varia quando
varia a temperatura e está relacionado com energia cinética das moléculas e a
agitação provocada nas moléculas gera um movimento elástico entre elas,
provocando expansão ou compressão desse gás ao variar a temperatura do sistema.
3) Como é a realização de
trabalho de um gás?
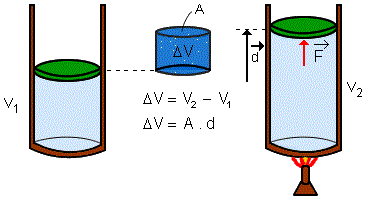
O trabalho de um gás será a relação entre a pressão do ambiente em que o gás está contido e a variação do volume que ele ocupará com a mudança de temperatura:
τ = p ∙ ΔV.
Onde, no SI, as unidades são definidas por:
τ = trabalho [ J ];
p = pressão [ Pa ];
V =
volume [ m3 ].
4) Como é notada a ação do
trabalho do gás?
A pressão é considerada sempre positiva e, como consequência, o sinal do trabalho é determinado pelo sinal da variação do volume do gás.
Quando o gás se expande, a variação do volume é positiva implicando num trabalho positivo.
Quando
o gás se comprime, a variação do volume é negativa implicando num trabalho
negativo. Na prática se diz que:
Expansão do gás: “O Gás realiza trabalho sobre o Meio Exterior”
Compressão do gás: “O Meio Exterior realiza trabalho sobre o Gás”
4) Como são tratadas as
transformações gasosas na realização de
trabalho?
Características das transformações em um sistema fechado sob a
perspectiva da primeira lei da Termodinâmica:
a) Se há realização de trabalho sobre o sistema, o volume do gás
diminui.
b) Na situação inversa, se há realização de trabalho pelo sistema, o
volume do gás aumentará.
c) O aumento da energia interna é mostrado pelo aumento da temperatura
do gás.
d) No caso inverso, ou seja, uma diminuição da energia, é evidenciado
por uma redução da temperatura do gás.
A menos que o sistema seja adiabático (isto é, termicamente isolado),
ganhos e perdas de calor sempre estarão presentes pelo fato de existir
diferença entre as temperatura do sistema e do exterior.
5) Quais os efeitos na
realização de trabalho nos diversos tipos de transformações gasosas?
Há três transformações particulares que podem ocorrer em um sistema
isolado: a isotérmica (a temperatura constante), a isovolumétrica (a volume
constante) e a adiabática (sem trocas de calor).
a) Transformação isotérmica:
Acontece a temperatura constante → ΔU = 0
Q = τ
Na transformação isotérmica, duas situações são possíveis:
1: todo o calor absorvido se transforma em trabalho realizado pelo
sistema, Q > 0.
2: todo o trabalho recebido pelo sistema passa a ser rejeitado na forma
de calor, Q < 0.
Na prática, o processo isotérmico dificilmente ocorrerá. Porém, é
possível aproximá-lo por uma transformação em que um reservatório térmico
recebe (ou cede) calor ao sistema enquanto o gás comprime (expande) lentamente.
b)Transformação isovolumétrica
Chamada também de isocórica, acontece a volume constante → τ = 0
ΔU = − Q
Na isovolumétrica, duas situações são possíveis:
1: toda a diminuição obtida na energia interna é rejeitada sob forma de
calor
2: todo o calor absorvido se converte em aumento da energia interna
A transformação isovolumétrica acontece, por exemplo, quando temos pinos
fixados no recipiente de paredes rígidas com o objetivo de impedir o movimento
do êmbolo.
c) Transformação adiabática:
Acontece na ausência de trocas de calor com o exterior → Q = 0
ΔU = τ
Na adiabática, são possíveis duas situações:
1: toda a redução da energia interna se converte em trabalho realizado
pelo sistema
2: todo o trabalho realizado sobre o sistema se converte em aumento da
energia interna
A transformação adiabática pode ocorrer se o sistema for recoberto ou
mesmo fabricado com um material que aja como um isolante térmico.
d) Transformação isobárica
Acontece na pressão constante → Δp = 0
Q = τ + ΔU
A variação do volume é proporcional à variação da temperatura:
1: no caso de expansão, há aumento do volume e da temperatura do gás, ΔU
> 0
2: no caso de compressão, há diminuição do volume e da temperatura, portanto, ΔU < 0.
6) Um exemplo de sistema:
Muitas
usinas e motores operam transformando energia térmica em trabalho. Isso porque
um gás aquecido pode realizar trabalho em turbinas mecânicas ou pistões,
fazendo com que eles se movam.
A
primeira lei da termodinâmica aplica o princípio de conservação de energia a
sistemas onde a transferência de energia para dentro e para fora do sistema se
dá pela transferência de calor e pela realização de trabalho.
A
primeira lei da termodinâmica diz que a variação na energia interna de um
sistema (ΔU) é igual à transferência de calor resultante para dentro e para
fora do sistema (Q), mais o trabalho resultante realizado no sistema (W). Na
forma de equação, a primeira lei da termodinâmica é,
ΔU = Q + W
Ela
simplesmente diz que você pode aumentar a energia interna de um sistema
aquecendo-o ou realizando trabalho nele.
O
que significa cada um desses termos?
Nada
exemplifica a primeira lei da termodinâmica tão bem quando um gás preso em um
recipiente com um pistão móvel encaixado firmemente (como mostrado na Figura
1). Vamos considerar que o pistão possa se mover para cima e para baixo,
comprimindo o gás ou permitindo que ele se expanda (mas o gás não pode sair do
recipiente).
Figura 1: Esquema de um pistão de gás. Crédito: Khan Academy.
Disponível em https://pt.khanacademy.org/science/physics/thermodynamics/laws-of-thermodynamics/a/what-is-the-first-law-of-thermodynamics. Acesso em 18/09/18.
As moléculas de gás presas no recipiente são o sistema. Atente que elas se movimentam, possuindo energia cinética e temperatura maior do que o zero absoluto ou 0K.
A
energia interna U deste sistema pode ser pensada como a soma de todas as
energias cinéticas de todas as moléculas de gás presas dentro do recipiente.
Assim, se a temperatura T do gás aumenta, as moléculas aumentam sua velocidade
e a energia interna U do gás também aumenta (o que significa que ΔU é
positivo).
Da
mesma forma, se a temperatura T do gás diminui, as moléculas diminuem sua
velocidade, e a energia interna U do gás também diminui (o que significa que ΔU
é negativo).
É
realmente importante lembrar que a energia interna U e a temperatura T irão
aumentar quando a velocidade das moléculas de gás aumentar, já que elas são, na
verdade, duas maneiras de medir a mesma coisa: quanta energia há em um sistema.
Como
a temperatura e a energia interna são diretamente proporcionais, temos que, se
a energia interna dobrar de valor, a temperatura também dobrará.
Da
mesma forma, se a temperatura não alterar seu valor, a energia interna também
não irá variar.
A
energia interna U deste sistema e sua temperatura podem ser aumentadas pela
transferência de calor Q para o gás. Para fazer isso basta colocar o recipiente
sobre uma chama ou submergi-lo em água fervendo.
A
alta temperatura do ambiente externo, em relação às paredes e interior do
recipiente, fará com que o calor flua para o interior e aqueça o gás, fazendo
com que suas moléculas se movam mais rápido. Quando o calor é absorvido e
aquece o gás, Q é um número positivo.
Por
outro lado, podemos diminuir a energia interna do gás transferindo calor para
fora dele. Isso pode ser feito colocando o recipiente em um banho de gelo. Se o
calor deixar o gás, Q será um número negativo.
Essa
convenção de sinais para o calor Q está representada na Figura 2.
Figura 2: Convenção de sinal para calor recebido e doado pelo
sistema. Crédito: Khan Academy. Disponível em https://pt.khanacademy.org/science/physics/thermodynamics/laws-of-thermodynamics/a/what-is-the-first-law-of-thermodynamics. Acesso em 18/09/18.
Como
o pistão pode se mover, ele pode realizar trabalho no gás, movendo-se para
baixo e comprimindo o gás.
A
colisão do pistão que se move para baixo com as moléculas de gás faz com que as
moléculas se movam mais rápido, aumentando a energia interna total do sistema.
Se o gás for comprimido, o trabalho realizado no gás W será um número positivo.
Por
outro lado, se o gás se expande e empurra o pistão para cima, um trabalho é
realizado pelo gás. A colisão das moléculas de gás com o pistão que recua faz
com que as moléculas se movam mais devagar, diminuindo a energia interna do
gás. Se o gás se expande, o trabalho realizado no gás W é um número negativo.
Essa
convenção de sinais para o trabalho W está representada na Figura 3.
Figura 3: Convenção de sinal para o trabalho realizado pelo
sistema e sobre o sistema. Crédito: Khan Academy. Disponível em https://pt.khanacademy.org/science/physics/thermodynamics/laws-of-thermodynamics/a/what-is-the-first-law-of-thermodynamics. Acesso em 18/09/18.
Na
tabela abaixo resumimos as convenções de sinais para as três grandezas da 1ª
Lei da Termodinâmica:
|
ΔU
(variação na energia interna) |
Q
(calor) |
W
(trabalho realizado no gás) |
|
+
se T aumenta |
+
se entrar calor no gás |
+
se o gás for comprimido |
|
−
se T diminui |
−
se o calor deixar o gás |
−
se o gás se expandir |
|
Zero
se T for constante |
Zero
se não houver troca de calor |
Zero
se o volume for constante |














Nenhum comentário:
Postar um comentário